Ricercatrice di “Tor Vergata” identifica proteina centrale nello sviluppo del diabete di tipo 2
La scoperta, pubblicata su “Cell Metabolism”, grazie alla tecnologia "fosfoproteomica"
Francesca Sacco, 34 anni, ricercatrice del Dipartimento di Biologia dell’Università di Roma “Tor Vergata”, ha pubblicato sulla prestigiosa rivista internazionale “Cell Metabolism” i risultati di una ricerca che identifica i meccanismi molecolari che determinano la degenerazione funzionale nel diabete di tipo 2 delle isole di Langerhans, sensori del glucosio che si trovano all’interno del pancreas e che attraverso la produzione dell’ormone insulina regolano la concentrazione di glucosio nel sangue.
Il diabete di tipo 2, la forma più diffusa di diabete, è caratterizzato, da un lato, dalla perdita progressiva della funzionalità delle isole di Langerhans, che diventano incapaci di produrre insulina, dall’altro, da una insoddisfacente risposta di vari organi periferici, come fegato e muscoli, all’insulina.
«La concentrazione di glucosio nel sangue, la glicemia, è regolata da un complesso circuito cellulare e molecolare coordinato dall’ormone insulina. -spiega la ricercatrice - Attraverso la produzione di tale ormone le isole di Langerhans nel pancreas regolano la glicemia. L’insulina, a sua volta, stimola alcuni organi, come il fegato e i muscoli, a prelevare il glucosio dal sangue, limitando di conseguenza l’innalzamento della glicemia. Un qualsiasi difetto in questo complesso sistema di regolazione causa il diabete, una sindrome metabolica che affligge circa 350 milioni di persone nel mondo».
Francesca Sacco ha descritto i meccanismi molecolari che controllano la produzione di insulina in risposta alle variazioni della concentrazione di glucosio e ha identificato una proteina, GSK3, la cui attività è responsabile della degenerazione funzionale delle isole di Langerhans.
«Grazie alla collaborazione con il gruppo del Prof. Matthias Mann dell’Istituto Max Planck di Biochimica a Monaco (Germania) e all’utilizzo di un’avanzata tecnologia di cui l’Istituto dispone nel campo della ricerca proteomica, ovvero l’identificazione delle proteine rispetto alla loro identità, quantità, struttura e alle loro funzioni biochimiche e cellulari, abbiamo scoperto che le alte concentrazioni di glucosio ematiche attivano la proteina GSK3, laddove questa non dovrebbe attivarsi, e che questa, a sua volta, blocca la produzione di insulina. - dichiara la ricercatrice di “Tor Vergata” – La tecnologia che abbiamo utilizzato per l’indagine molecolare è chiamata “fosfoproteomica” e ci ha permesso di descrivere non solo le proteine presenti nel pancreas ma anche la loro attività».
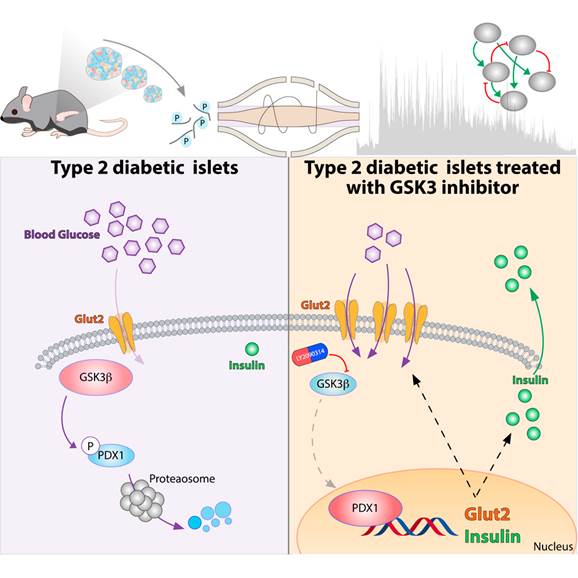
La ricerca ha dimostrato che inibendo a livello farmacologico la proteina GSK3, nei topi veniva ripristinata la produzione di insulina e dunque la funzionalità delle isole di Langerhans di topi diabetici, aprendo così la strada allo sviluppo di nuove strategie terapeutiche per combattere il diabete di tipo 2.
Francesca Sacco, 34 anni, ha trascorso 5 anni nel laboratorio del Prof. Matthias Mann, dell’Istituto Max Planck di Biochimica a Monaco. A settembre del 2017, con la borsa di studio “L'Oréal Italia per le donne e la scienza” è rientrata in Italia, all'Università di Roma “Tor Vergata”. Qualche mese dopo è diventata ricercatore nel dipartimento di Biologia di “Tor Vergata” grazie al programma per Giovani Ricercatori “Rita Levi Montalcini” del MIUR che permette la reintegrazione in una Università statale italiana di giovani scienziati che hanno lavorato all’estero presso una Università o Centro di Ricerca. Oggi, grazie a un finanziamento AIRC Grant Start-Up, conduce un gruppo di ricerca a “Tor Vergata” per lo studio della resistenza alla chemioterapia di leucemie mieloidi acute, utilizzando la tecnologia della proteomica.
Phosphoproteomics Reveals the GSK3-PDX1 Axis as a Key Pathogenic Signaling Node in Diabetic Islets – "Cell Metabolism" - Abstract creare link ipertestuale a https://www.cell.com/cell-metabolism/fulltext/S1550-4131(19)30076

